藥華藥 臺中、竹北新藥產能就位

圖/本報資料照片
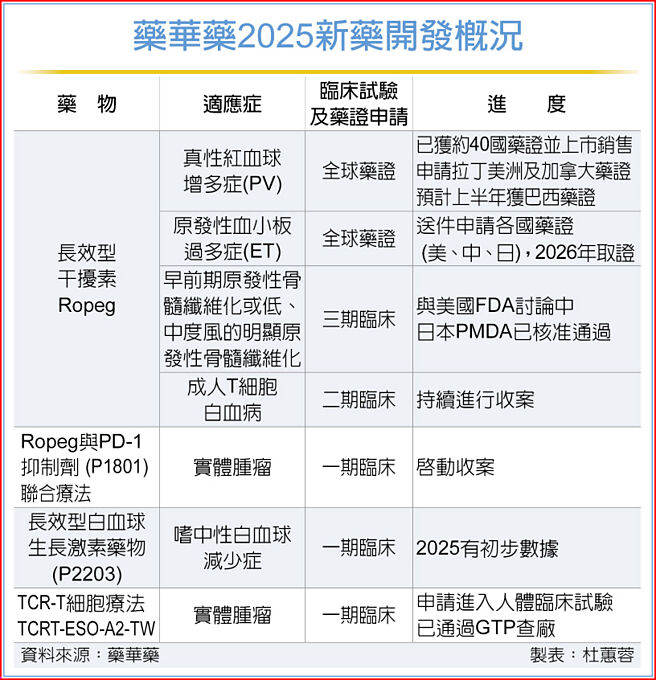
藥華藥2025新藥開發概況
藥華藥去年大賺近30億元,正式進入獲利新紀元,每股稅後純益(EPS)達8.96元。全球營運新事業發展副處長謝殷程27日在法說會中表示,在多國公告競爭藥物Pegasys斷貨下,臺中廠第二條產線已完成擴建,竹北新廠預計2026年加入量產,目前Ropeg產能已備妥,將全力供應全球需求。
另外,藥華藥與授權夥伴AOP的官司,公司預估仲裁程序可能延續至明年以後,藥華藥不排除尋求調解途徑。
藥華藥受惠治療真性紅血球增多症(PV)新藥Ropeg全球銷售成長,去年營收達97.3億元、年增91%,本業獲利17.4億元,稅後純益29.7億元,EPS達8.96元,營收、本業獲利、淨利及EPS均創歷史新高。其中,去年第四季營收30.6億元,連續七個季度創新高,稅後純益12.4億元,季增72%、年增966%績,EPS達3.73元。
藥華藥將首度配發股利,董事會通過擬配發每股2.2元股利,其中現金、股票各1.1元。
謝殷程表示,近期歐洲、美國、加拿大、巴西等多國衛生主管機關陸續公告Ropeg競爭藥物Pegasys斷貨,預計明年5月31日纔可能恢復供應。
爲確保治療PV藥物全球供應鏈穩定,藥華藥臺中廠第二條產線已完成擴建,製程確效進入最後階段,準備向美國及歐盟提出廠證申請。該產能倍增後,可供應2萬名以上病患。另外,新建竹北廠,預計明年投產,總產能將可供應全球10萬名以上病患。
展望未來,藥華藥已積極拓展Ropeg應用至其他骨髓增生性腫瘤(MPN)領域,適應症包括原發性血小板過多症(ET)和原發性骨髓纖維化(PMF),今年將送件申請美國、日本及中國等多國ET藥證,力拚2026年取證。而PMF全球第三期臨牀試驗,目前正在與美國FDA討論中,日本PMDA則已覈准通過。
另外,Ropeg以外的新藥臨牀試驗進度亦進展順利,長效型顆粒性白血球生成素(PEG-GCSF)在臺灣進行的一期臨牀試驗收案完成,預計第二季有初步數據。PD-1抑制劑P1801接續Ropeg,兩者搭配用於治療末期腫瘤患者的一期臨牀試驗,預計今年上半年開始在臺灣收案。
至於與AOP的仲裁庭,藥華藥預計3至4月雙方將討論後續程序。法律團隊研判該案可能曠日廢時,初步預估仲裁程序2025年內尚不會終結,不排除尋求調解途徑。









